従来の薬事法ではソフトウェア部分のみでは規制対象とならず、ハードウェア部分に組み込んだ形で規制していましたが、2014年に施行された「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(医薬品医療機器等法)」では、ソフトウェアを単体で流通することを可能とし、「医療機器プログラム」として規制対象とすることとなりました。
医療機器ソフトウェア・・・予防・診断・治療を目的としたソフトウェアが該当します。
・装置の中に組み込まれて動く組み込みソフトウェア
・汎用デバイス(パソコンやスマートフォン)で動作するソフトウェア
・インターネット上で提供されるサービスソフトウェア等
●医療機器で得られたデータ(画像を含む)を加工・処理し、診断又は治療に用いるための指標、画像、グラフ等を作成するプログラム
●治療計画・方法の決定を支援するためのプログラム(シミュレーションを含む)
●医療機器で取得したデータを、診療記録として用いるために転送、保管、表示を行うプログラム
●データ(画像は除く)を加工・処理するためのプログラム(診断に用いるものを除く)
●教育用プログラム
●患者説明用プログラム
●メンテナンス用プログラム
医療機器ソフトウェアを製造・販売するためには
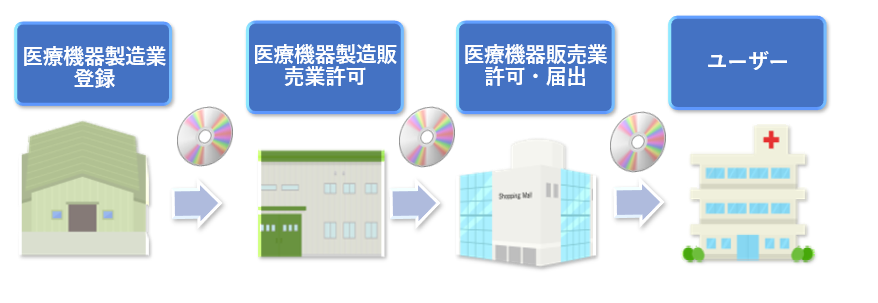
医療機器プログラムを製造して、医療機関に販売するためには、法律で定められた業態である「医療機器製造業」、「医療機器製造販売業」、「医療機器販売業」の登録・許可などに関する手続きを行う必要があります。
製品の承認申請
医療機器ソフトウェアを製造販売するには、その使用目的、効能又は効果等に関する審査等が必要となるため、製造販売業者が製造販売承認申請等を行う必要があります。
製造販売承認申請・製造販売認証申請はそれぞれ、医薬品医療機器総合機構(PMDA) 、登録認証機関 となります。
IEC62304とは
IEC62304は医療機器ソフトウェアの安全性の向上を目的として、ソフトウェア開発及び保守に関する要求項目を規定した規格です。 医療機器ソフトウェアの開発及び保守プロセスにおいてIEC62304(国内のJIS規格はJIS T 2304が相当)の要求事項に適合させる必要があります。
日本以外でも欧州・北米などにおいてIEC62304が適用されるようになってきており、医療機器申請時にIEC 62304に基づくソフトウェア開発の証拠が必要となっています。
