医療機器を販売するためには
医療機器は、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」により規制されているため、国内で製造した医療機器を販売・授与するためには、通常、医療機器製造販売業許可及び医療機器製造業登録が必要となります。さらに、許可等のほかに、原則、取り扱う品目ごとに医療機器製造販売承認又は医療機器製造販売認証を取得する必要があります。
また、海外から輸入した医療機器を販売・授与するためには、通常、医療機器製造販売業許可及び海外の製造所については外国製造業登録が、国内で保管する場所については医療機器製造業登録が必要となります。
製造許可・登録についてのながれ
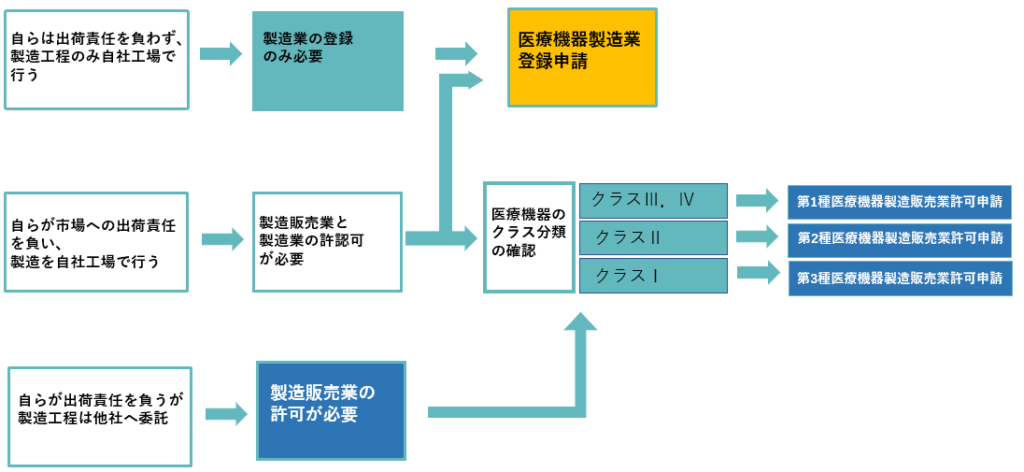
医療機器製造業と医療機器製造販売業の違い
| 医療機器製造業 |
|
商品を製造する業者 |
| 医療機器製造販売業 |
| 市場にある製品に対して最終的な責任を負う業者 医療機器の製造販売承認(認証)申請を行い、市販する製品についての品質及び安全性についての責任を負います。 医療機器製造販売業の許可のみでは、医療機器を製造することはできません。 |
医療機器製造業とは
| 医療機器製造業とは、製造販売業者の委託を受け、製品の製造を行う業者 認められているのは製造だけであって、製品を市場に出荷することはできません。 製造した製品は医療機器製造販売業者または医療機器製造業者にのみ販売・貸与・授与することができ、医療機器販売業者やユーザーへの販売は行なうことができません。 |
※製造行為には保管も含まれます。(包装・表示のみを行っている施設は登録対象とはなりません)
※企業ごとではなく、製造所ごとに受ける必要があります。
医療機器製造業の登録が必要な工程
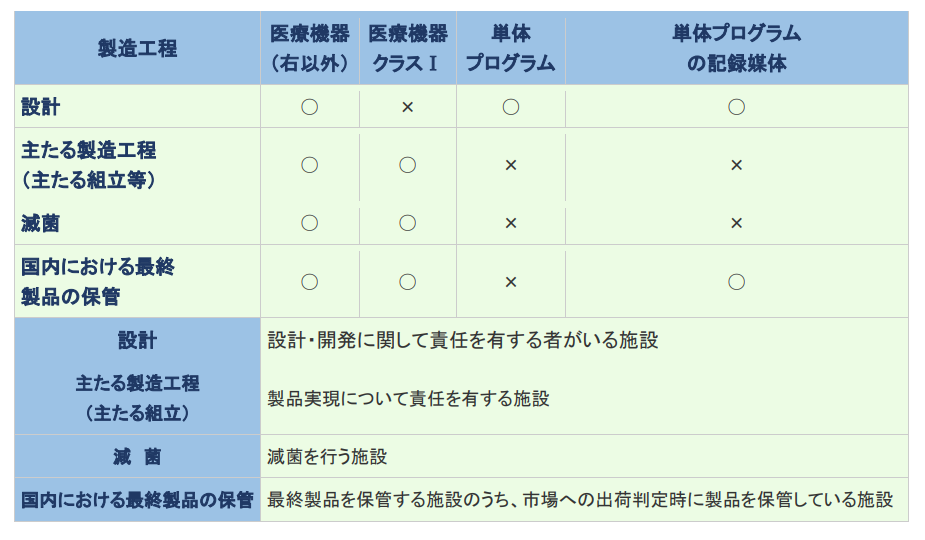
医療機器製造業の登録要件
医療機器製造業登録は、製造所の所在地を管轄する都道府県知事が与えることになっています。
医療機器製造業登録を取得するためには、要件を満たしたうえで、都道府県知事に申請し、実地調査を受ける必要があります。
・責任技術者を配置する 医療機器の製造責任者となる責任技術者を選任する必要があります
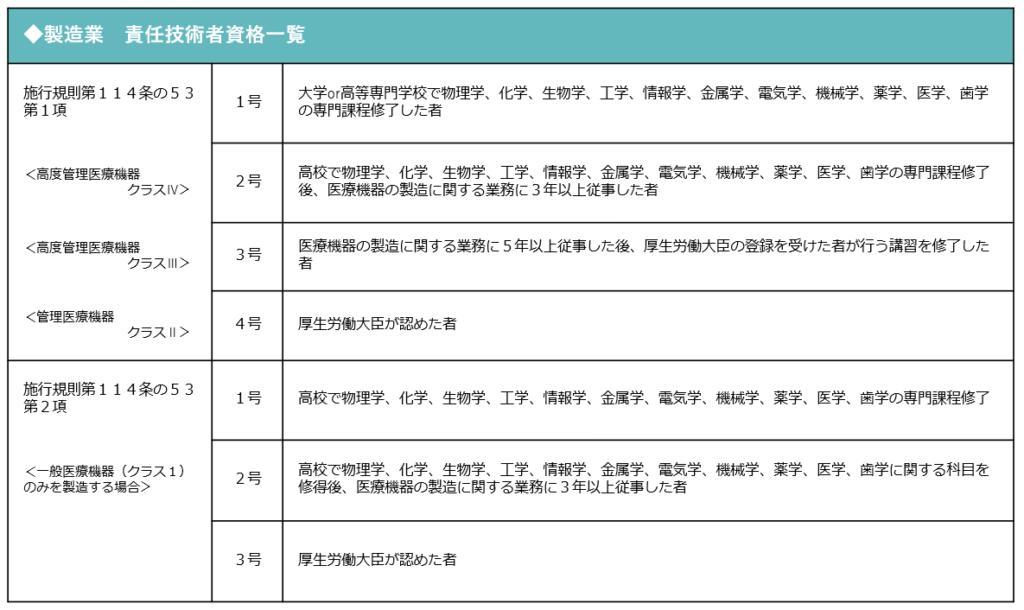
医療機器製造業登録要点
- 管理者として「製造業責任技術者」の資格を有する者の設置(常勤)が必要
- 製造所(工場)ごとに登録が必要→製造所を管轄する都道府県に申請
医療機器製造販売業の役割
| 医療機器製造販売業とは市場にある製品に対して最終的な責任を負う業者 医療機器を製造(他に委託して製造する場合を含みます)し、または海外で製造された医療機器を輸入した後に、販売業者等に対し医療機器を販売・貸与・授与を行うなどして、医療機器を市場に流通させる役割を担います。 |
医療機器製造販売業の許可の種類
| クラス | 分類 | 許可の種類 | 申請先 |
| Ⅳ | 高度管理医療機器 | 第一種医療機器製造販売業許可 | 都道府県 |
| Ⅲ | |||
| Ⅱ | 管理医療機器 | 第二種医療機器製造販売業許可 | |
| Ⅰ | 一般医療機器 | 第三種医療機器製造販売業許可 |
医療機器製造販売業の許認可要件
「医療機器製造販売業許可」の取得のためには大きく分けて以下2つの要件を満たす必要があります。
- QMS体制省令に適合した組織体制を構築すること
(製造所の製造管理や品質管理を管理監督することによって、製品の品質を確保すること)
- GVP省令に適合した安全管理体制を構築すること
(顧客に製品情報を提供し、品質や不具合等の安全情報等必要な情報を収集するなどして製造販売後の安全を確保すること)
上記を満たすためには、法令で定められた5つの役割を有する責任者を配置しなければなりません。
| 医療機器等総括製造販売責任者 | 管理監督者 | 管理責任者 |
| 国内品質業務運営責任者 | 安全管理責任者 |
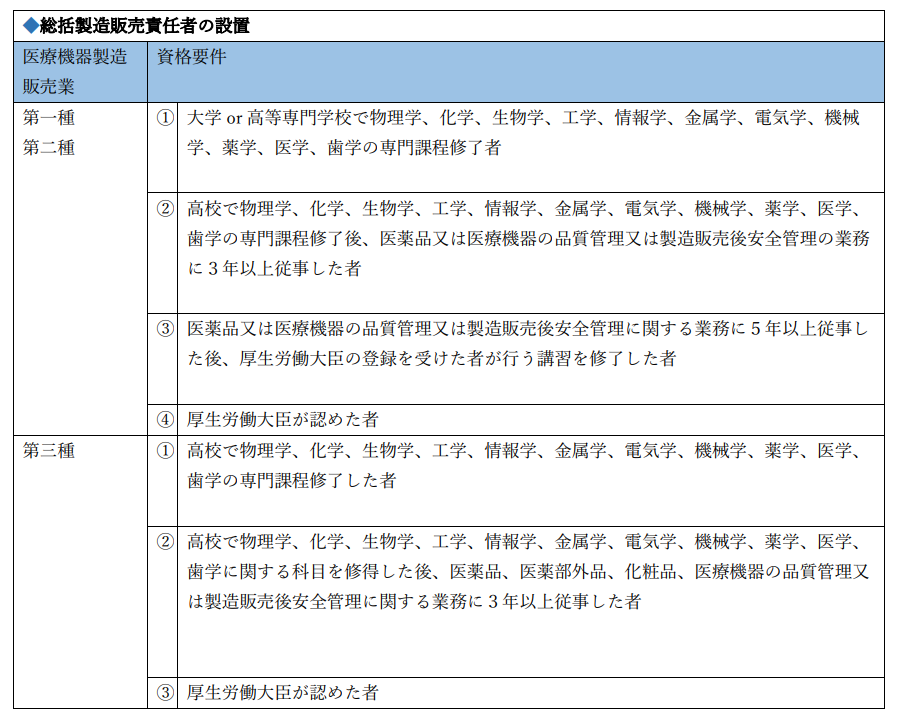
◆管理監督者の配置
代表取締役などの役員が、製造販売業者の品質管理システムに係る業務を最上位で管理監督する必要があります。
◆管理責任者の配置
製造販売業者等の役員、管理職の地位にある者その他これに相当する者のうちから製造販売業者等の品質管理監督システムの実施及び維持の責任者を選任する必要があります。
◆国内品質業務運営責任者の設置
国内品質業務運営責任者とは、医療機器の品質管理業務の責任者となり、市場への出荷判定や回収処理等を担当します。
品質管理業務には、知識経験が必要となるため、業務経験者を配置することが求められています。
国内品質業務運営責任者の資格要件は以下のすべての満たす方が就任することができます。
| 製造販売業者における品質保証部門の責任者であること |
| 品質管理業務その他これに類する業務に3年以上従事した者であること |
| 国内の品質管理業務を適正かつ円滑に遂行しうる能力を有する者であること |
| 医療機器等の販売に係る部門に属する者でないことその他国内の品質管理業務の適正かつ円滑な遂行に支障を及ぼすおそれがない者であること |
◆安全管理責任者の配置
安全管理責任者とは、医療機器の安全管理業務の責任者となり、取扱う医療機器に関して安全に関する情報を収集し、医療機器の製造に反映させる業務を担当します。
安全管理責任者の資格要件は以下のすべての満たす方が就任することができます。

医療機器製造業販売業許可要点
- 要件:品質保証と安全管理の体制を整える。総括製造販売責任者・安全管理責任者・国内品質業務運営責任者を設置する。
- 有効期間は5年→5年毎に許可更新手続きが必要
- 総括製造販売責任者がその業務を行う事務所(主たる機能を有する事務所)の所在地の都道府県に業者コードの登録を行い、その後、業許可申請。
ISO13485とは
ISO13485とは、医療機器向けの品質マネジメントシステムを構築、運用するために定められた国際規格です。
世界各国から医療関係者の代表が集まって作った「医療機器のルールブック」です。
医療機器の設計・開発、製造、販売、市販後の対応に際して、その手続きや守らなければいけないことが書かれています。
欧米に医療機器を輸出するような場合は、ISO13485の取得がほぼ必須となります。
QMSとは(Quality Management System)
日本国内で、ISO13485をベースにした省令をQMS省令(医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令)といいます。
旧薬事法では、製造販売業者にGQP省令に基づく品質管理態勢の構築が求められていましたが、現在GQPは医療機器製造販売業者には適用されておらず、GQPで求められていた事項は、QMS省令に移行しています。
QMSの管理体制
医療機器等製造販売業者はQMS省令を遵守するための体制を整備する必要があります。
具体的には以下の要求事項を満たす体制にあることを証明する書類を作成する必要があります。
| 品質管理監督システムの確立 |
| 品質管理監督システムの文書化及び実施並びにその実効性の維持 |
| 品質管理監督文書の管理 |
| 品質管理監督記録の管理 |
医療機器等製造販売業者はQMS省令の規定を遵守するために、それぞれの資格要件に応じた以下の人員の配置を適切に行う必要があります。
| 管理監督者【QMS省令第2条第16項】 |
| 管理責任者(限定第三種医療機器製造販売業者を除く)【QMS省令第16条】 |
| 医療機器等総括製造販売責任者【医薬品医療機器等法施行規則第114条の49】 |
| 国内品質業務運営責任者【QMS省令第72条第1項】 |
クラス2~4の医療機器は、承認・認証要件としてQMS省令に適合することが必要です。
クラス1医療機器については、製品の届出時等にQMS適合性調査を受ける機会はありません。
・製品の品質に関すること(製造販売品質保証基準)
・自社の製造工場や委託先製造業者が、きちんとした製造管理・品質管理を行っているかを
チェックするための基準
・製品の安全性に関すること(製造販売後の安全管理の基準)
・事故の未然防止と、問題発生時の迅速な対応のための仕組み
